瘧疾
| 瘧疾 | |
|---|---|
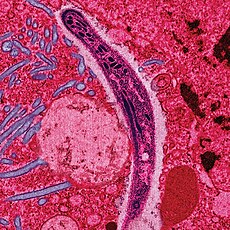
人體血液中的惡性瘧原蟲環狀體和配子母細胞
| |
| 分類和外部資源 | |
| 醫學專科 | 感染科[*] |
| ICD-10 | B50 |
| ICD-9 | 084 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| EMedicine | med/1385 emerg/305ped/1357 |
| Patient UK | 瘧疾 |
| MeSH | C03.752.250.552 |
瘧疾(英語:Malaria,中文俗稱「打擺子」、「冷熱病」[1])是一種會感染人類及其他動物的全球性寄生蟲傳染病,其病原瘧原蟲藉由蚊子散播[2],隸屬原生生物界,皆為單細胞生物。瘧疾引起的典型症狀有發燒、畏寒、虛弱、嘔吐和頭痛[3];在嚴重的病例中會引起黃疸、癲癇發作、昏迷或死亡[4]。這些症狀通常在蚊子叮咬後的十到十五天內出現,若病人沒有接受治療,症狀緩解後數月內症狀可能再次出現[2]。曾感染瘧疾的患者再次感染所引起的症狀通常較輕微,如果患者沒有持續暴露於瘧疾的環境,此種部分抵抗力會在數月至數年內消失[4]。
瘧疾最常透過受感染的雌性瘧蚊來傳播,瘧原蟲會在瘧蚊叮咬時從蚊子的唾液傳入人類的血液[2],接著瘧原蟲會隨血液移動至肝臟,在肝細胞中發育成熟和繁殖。瘧原蟲屬(Plasmodium)中有五個種可以感染人類並藉此散播[4],多數死亡案例由惡性瘧(P. falciparum)、間日瘧(P. vivax)及卵形瘧(P. ovale)所造成,三日瘧(P. malariae)產生的症狀較輕微[2][4],而猴瘧蟲(P. knowlesi,又稱諾氏瘧原蟲)則較少造成人類疾病[2]。瘧疾的診斷方式主要為血液抹片鏡檢或前者配合快速瘧疾抗原診斷測試[4],近年也發展聚合酶鏈式反應來偵測瘧原蟲的DNA,但因為成本和複雜性較高,目前尚未廣泛地應用於瘧疾的盛行地區[5]。
避免瘧蚊叮咬能降低感染瘧疾的風險,實務上包括使用蚊帳、防蚊液或控制蚊蟲生長(如噴灑殺蟲劑和清除積水)[4]。前往瘧疾盛行地區的旅客可以使用數種藥物來預防瘧疾,而瘧疾好發地區的嬰兒及第一個三月期以後的孕婦也建議適時使用周效磺胺/比利美胺進行防治[6][7]。20世紀中葉,以屠呦呦為首的中國科學家研製出抗瘧效果良好的藥物青蒿素,屠呦呦也因此獲得2015年諾貝爾生理醫學獎[8]。儘管有所需求,但瘧疾目前尚無疫苗,相關研究仍在進行[2]。現在建議的治療方法是併用青蒿素及另一種抗瘧藥物[2][4](可能是甲氟喹、苯芴醇或周效磺胺/比利美胺[9]);如果青蒿素無法取得,則可使用奎寧加上去氧羥四環素[9]。為避免瘧原蟲抗藥性增加,瘧疾盛行地區的病患應盡量在確診後才開始投藥。瘧原蟲已逐漸對幾種藥物產生抗藥性[10],具有氯化奎寧(氯喹)抗性的惡性瘧已經散布到多數的瘧疾盛行區,青蒿素抗藥性的問題在部分東南亞地區也日益嚴重[2]。
瘧疾普遍存在熱帶及亞熱帶地區位於赤道周圍的廣大帶狀區域[4],主要流行地區包括非洲中部、南亞、東南亞及南美北部,這其中又以非洲的疫情最甚[11]。瘧疾與貧困息息相關,嚴重影響經濟發展[12][13],瘧疾會造成醫療衛生支出增加、勞動力減少、並衝擊觀光業,非洲每年估計因瘧疾損失120億美元[14]。根據世界衛生組織的統計,2013年全球瘧疾病例共有1.98億例[15],造成584,000至855,000人死亡,當中有90%是在非洲發生[16][2]。
歷史[編輯]
惡性瘧原蟲已存在約5至10萬年,但直到1萬年前族群數量才開始增加,這可能與人類發展農業並群聚定居有關[17]。人類瘧原蟲的近親物種迄今仍時常感染黑猩猩,一些證據顯示惡性瘧原蟲可能源於感染大猩猩的物種[18]。公元前2700年起,中國就有關於瘧疾引起的獨特的周期性發燒的歷史記載[19]。希波克拉底按發熱周期把瘧疾分為間日瘧、三日瘧、次間日瘧和每日瘧[20]:3。羅馬人科魯邁拉也曾經提到瘧疾可能與沼澤有關[20]:3。瘧疾在羅馬非常流行,以致它有「羅馬熱」之稱[21],並可能和羅馬帝國的衰落有關[22]。當時羅馬帝國內的南義大利、薩丁尼亞島、彭甸沼地、伊特魯里亞沿岸、及羅馬城的台伯河沿岸由於氣候條件適宜病媒蚊生長,推測可能是當時的疫區。這些地區的灌溉花園、沼澤地、田地徑流,和道路積水為蚊子提供了繁殖的理想場所[23]。
瘧疾在中國歷史上很早就有所紀載。《尚書·金滕》中就有提到就曾記載周武王「遘厲虐疾」[註 1],然而此處的「虐疾」是否真正指現代意義的瘧疾已無從稽考[24]。「瘧」在中國作為一個專屬病症名可以追溯到《左傳》[註 2]。《說文》中釋「瘧」為「熱寒休作,从广从虐,虐亦聲」[24]。
瘧疾的英文「malaria」最早於1829年見諸文獻[20],此字源自於中世紀義大利文的「mala aria」,意為「瘴氣」。在這之前有文獻稱瘧疾為「ague」,或是「沼澤熱」(marsh fever ),此乃因瘧疾常發生於沼澤地區[25]。瘧疾曾經是歐洲和北美最常見的疾病[26],雖然現在已經不再流行[27],但境外移入病例仍時有所聞[28]。
1880年,瘧疾在科學研究上取得重大進展。法國軍醫夏爾·路易·阿方斯·拉韋朗在阿爾及利亞君士坦丁首次發現瘧疾感染者的紅血球里有寄生蟲,於是他提出這種寄生蟲是導致瘧疾的生物,這是人類發現的第一種致病的原生生物,這項發現也使他獲得1907年諾貝爾生理學或醫學獎[29]。一年後,古巴醫生卡洛斯·芬萊在哈瓦那為人治療黃熱病時,發現了蚊子在人際間傳播疾病的有力證據[30],他的研究乃奠基於約西亞·克拉克·諾特[31]和「熱帶醫學之父」萬巴德爵士在絲蟲病傳播上的研究[32]。
1894年4月,蘇格蘭內科醫師羅納德·羅斯拜訪萬巴德在倫敦安妮皇后街的住處,此後四年兩人潛心投入瘧疾研究。1898年,時任職於加爾各答總統府總醫院的羅斯證實蚊子是傳播鳥瘧疾的病媒,並提出瘧原蟲的完整生活史。他先讓蚊子叮咬感染瘧疾的鳥類,之後再取出蚊子的唾腺,並成功分離出瘧原蟲,進而推論蚊子是傳播人類瘧疾的病媒[33]。羅斯從印度醫療體系退休後,進入剛成立的利物浦熱帶醫學學校任職,並在埃及、巴拿馬、希臘,和模里西斯等地展開防疫工作[34]。1900年,沃爾特·里德(Walter Reed)領導的醫療委員會證實了芬萊和羅斯的發現,羅斯因此獲得1902年諾貝爾生理學或醫學獎[33]。威廉·戈加斯在興建巴拿馬運河的工程中採用了沃爾特對於衛生措施的建議,這些建議挽救了上千工人的生命,並為之後的防疫工作提供借鑑[35]。
第一種對瘧疾有效的治療方式是使用金雞納樹的樹皮,金雞納樹生長於秘魯安第斯山脈的山坡上。秘魯原住民將樹皮入酒來治療發燒,後來發現它也能用來治療瘧疾。該療法在1640年左右由耶穌會傳入歐洲,並於1677年收錄至倫敦藥典中[36]。直到1820年,樹皮中的有效成分奎寧才由法國化學家佩爾提埃和卡旺托分離出來[37][38]。
截至1920年代以前,奎寧都是主要的抗瘧藥,隨後其他藥物才陸續開發出來。1940年代,氯喹取代奎寧用於治療瘧疾;但1950年代,東南亞和南美首先出現了抗藥性瘧疾;1980年代時抗藥性病株更已傳播至全球[39]。1970年代,中國科學家屠呦呦和同事參考《肘後備急方》中記載的:「治瘧病方……青蒿一握,以水二升漬,絞取汁,盡服之」[40]。終於從黃花蒿中發現青蒿素。青蒿素和其他抗瘧藥聯用的「青蒿素聯合療法」成為治療惡性和重症瘧疾的推薦療法[41]。屠呦呦因此獲得2015年諾貝爾生理學或醫學獎[42]。
1917年到1940年代,間日瘧原蟲曾用於瘧疾療法(malariotherapy),即注射瘧原蟲進入人體以引起高燒來治療疾病(如三期梅毒等)。發明者朱利葉斯·華格納-堯雷格因此獲得諾貝爾生理學或醫學獎。不過這個方法很危險,會導致15%的患者死亡,所以已經停止使用[43]。
在DDT發明之前,巴西和埃及等熱帶地區就曾向積水中噴灑劇毒的含砷化合物巴黎綠來破壞孑孓(蚊子幼蟲)的棲息繁殖環境,成功控制了瘧疾疫情[44]。第一種用於室內噴灑的殺蟲劑是DDT[45]。儘管DDT原先只是用來控制瘧疾,後來農業也開始大量噴灑以防治害蟲。DDT的濫用導致很多地區出現耐藥的蚊子,斯氏瘧蚊對DDT的抗藥性和細菌的抗生素抗藥性類似。1960年代,公眾開始意識到DDT濫用的危害,最後很多國家在1970年代禁止在農業中使用DDT[46]。
目前有效的瘧疾疫苗尚未開發出來。1967年,科學家曾將受過輻射減毒後的瘧原蟲子孢子注入小鼠體內,成功引起了免疫反應,為瘧疾疫苗的研製帶來第一縷曙光。1970年代起,許多科學家投入大量精力於開發人類瘧疾疫苗[47]。
主要病徵[編輯]
瘧疾會在瘧原蟲感染後8-25天出現症狀[48],預防性服藥可能延遲發病[5]。病人早期的症狀和流行性感冒類似[49],最典型的症狀為發燒、畏寒、接著冒冷汗,其他可能的症狀包括頭痛、顫慄、關節痛、嘔吐、溶血反應、瘧原性貧血、黃疸、血尿、視網膜損害、抽搐等[50]。由於瘧原蟲的生理活動有明顯的日夜周期,病患會陣發性地顫慄、發燒、冒冷汗。間日瘧和卵形瘧的活動周期為2天(病患每2天會發燒一次);三日瘧為3天;惡性瘧一般為36至48小時,但也可能持續發燒而無明顯週期。[51]
併發症[編輯]
瘧疾常會導致一些嚴重的併發症。呼吸困難是惡性瘧患者常見的併發症,多達25%的成人和40%的幼童會有此症狀,成因可能是代謝性酸中毒造成的呼吸代償、非心源性肺水腫、併發性肺炎和貧血;急性呼吸窘迫症候群在患有惡性瘧的兒童中很少見,但卻出現於5–25%的成人和多達29%的孕婦[52]。腎衰竭是黑水熱的重要特徵,瘧原蟲造成溶血後血紅素進入尿液,而使尿液呈暗紅色至黑色[49]。同時感染愛滋病的瘧疾患者死亡風險會提高[53]。
惡性瘧可能會影響腦部而導致腦瘧疾,視網膜白化為此病臨床上重要的判斷依據[54],其他症狀包括脾臟腫大、肝腫大、嚴重頭痛、低血糖,以及腎衰竭造成的血紅蛋白尿[49]。其併發症包括自發性出血、凝血功能障礙、和休克[55]。孕婦得到瘧疾可能會造成死胎、流產、和胎兒體重過輕[56],這些症狀特別常見於惡性瘧患者,但也發生於部分間日瘧病例[57]。
病因[編輯]
瘧疾的致病原是瘧原蟲,一種胞內寄生的單細胞生物,屬於頂複門瘧原蟲屬。它們以瘧蚊作為中間宿主,透過雌蚊叮咬來傳播病原體[58]。瘧原蟲可以感染大部分的脊椎動物,這使得得生物學家可以通過建立生物模型(例如用老鼠做瘧疾病理研究)來研究瘧疾[58]。
種類[編輯]
瘧原蟲屬中目前確認能感染人類的有五種[59][60]:惡性瘧原蟲(Plasmodium falciparum)、間日瘧原蟲(P. vivax)、三日瘧原蟲(P. malariae)、卵形瘧原蟲(P. ovale)、諾氏瘧原蟲(P. knowlesi)。惡性瘧是最常見的感染性瘧原蟲(75%),亦是造成患者死亡率最高的種類[5];間日瘧是第二常見的瘧原蟲(20%),也是非洲以外地區最常見的種類[61];傳統上認為惡性瘧造成多數的死亡病例[62],但近期研究顯示間日瘧對患者造成的生命威脅可能和惡性瘧差不多[63]。雖然曾有文獻指出一些猿類可能會傳染瘧疾給人類,但除了諾氏瘧原蟲之外,其餘都沒有公共衛生上的重要性[64]。
中國以間日瘧最為常見,惡性瘧其次,三日瘧和卵形瘧則較罕見。惡性瘧主要發生在西南與海南,間日瘧常發生在東北、華北、西北[65] 。全球暖化增加了瘧蚊的活動範圍,但對於瘧疾傳播的影響至今仍不明確[66][67]。
生活史[編輯]
瘧原蟲的生命周期很複雜,雌瘧蚊是瘧原蟲的最終宿主兼傳播媒介。雌瘧蚊唾液中長梭形的子孢子會叮咬的過程進入人體,並隨血液運移到肝臟,於肝細胞內行無性生殖。子孢子在肝細胞內發育成熟後會分裂成數以千計的裂殖子,破壞肝細胞進入血液中,這個過程稱為組織裂體生殖。裂殖子接著侵入紅血球,依序發育為環狀體(即早期滋養體)、滋養體、裂殖體,裂殖體成熟後會釋放出8到24個裂殖子,這個過程稱為血液裂體生殖。[68]:70-71
大部分的裂殖體會反覆感染紅血球並產生更多的裂殖體,只有少部分在侵入紅血球後會發育為配子母細胞,同個紅血球內的裂殖子會遵循相同的發育模式,且當環境惡劣時發育為配子母細胞的機率較大。在瘧蚊叮咬人體時,瘧原蟲隨血液進到瘧蚊的腸道,環境溫度降低和pH值改變促使配子母細胞發育為配子,進入有性生殖世代。雌、雄配子在中腸成熟後結合為合子,合子接著變長成為具活動力的卵動子,卵動子再穿出腸壁,在腸壁下形成卵囊。瘧原蟲在卵囊中行無性生殖,形成具單套染色體的子孢子,卵囊在成熟後破裂,子孢子進入蚊子的血體腔,穿透各種組織後進入蚊子的唾腺,準備感染新的脊椎動物宿主。[68]:70-71[69][70]
瘧疾復發[編輯]
瘧疾的患者可能會在一段無症狀期後復發,此種復發現象可依成因不同而分為再燃(recrudescence)、復發(relapse)、重複感染(reinfection)三種。再燃是導因於血液中殘存的瘧原蟲,無症狀期的病人體內雖仍有瘧原蟲,但沒有任何症狀顯現,這可能是治療不完全或療效不佳所致[9]:vi。復發是指患者血液中的瘧原蟲雖已悉數清除,但肝細胞中仍有瘧原蟲的休眠體(hypnozoites)存在;此類的病人無症狀期約有8至24週,這種現象在間日瘧和卵形瘧患者中常常發生[5],尤其溫帶地區的間日瘧會以休眠體「越冬」,也就是在患者感染後的隔年年初才復發[73]。重複感染是指患者在成功清除舊病原體後又感染了新病原體,重複感染在臨床上很難與復發區分,雖然兩週內再次出現的瘧疾通常是治療失敗造成的[9]:17。時常感染瘧疾的患者可能會產生一定的免疫力[74]。
其他動物[編輯]
目前為止已發現有將近200種瘧原蟲可以感染鳥類、爬蟲類、和其他哺乳類[75],有大約30種會感染人類以外的靈長類[76]。有些感染非人類靈長類的瘧原蟲可作為模式生物,例如柯氏瘧原蟲(P. coatneyi,為惡性瘧原蟲的模式生物)和食蟹猴瘧原蟲(P. cynomolgi,為間日瘧原蟲的模式生物),在非人靈長類身上診斷瘧原蟲的方式與人類相似[77]。感染齧齒類的瘧原蟲也常常用作模式生物研究,例如伯氏瘧原蟲(P. berghei)[78]。
鳥瘧疾的宿主通常是雀形目的鳥類,此種瘧疾給夏威夷、加拉巴哥群島和一些其他島嶼的鳥類帶來嚴重威脅。已發現殘瘧原蟲(P. relictum)會影響夏威夷特有鳥類的分布與數量。全球暖化給予了瘧原蟲更適宜的生活環境,屆時可能會造成鳥瘧疾更加肆虐[79]。
病理生理學[編輯]
致病機制[編輯]
瘧疾的感染分為兩個階段:包括瘧原蟲在肝細胞內發育的紅血球外期(exoerythrocytic phase)和瘧原蟲在紅血球內發育的紅血球內期(erythrocytic phase)。當受感染的瘧蚊叮咬人類時,瘧原蟲的子孢子會隨蚊子的唾液進入血流並移動至肝臟,在肝細胞內以無性繁殖大量增生,此時的病原體因受肝細胞的保護而難以透過免疫系統偵測[80],這段沒有症狀的時期持續約8至30天[81]。
經過一段潛伏期之後,瘧原蟲會產生數以千計的裂殖子,他們會打破肝細胞進入血液,侵入紅血球,開始紅血球內期。裂殖子在紅血球內無性繁殖,並週期性地由紅血球破出,接著再侵犯更多紅血球。病患會週期性的發燒就是裂殖子反覆地釋出和感染紅血球造成的[81]。有些間日瘧的子孢子在肝細胞內並不會快速發展為裂殖子,他們會先形成休眠體,潛伏7到10個月後才再度活化形成裂殖子(潛伏期也有可能長達數年)。間日瘧這種特殊的生活史造成了前述的「復發」現象[73],而卵形瘧是否也有這樣的生活史目前仍不清楚[82]。
瘧原蟲大部分的時間都棲居在肝細胞和紅血球中,因此可以輕易地躲避免疫系統偵測。但感染過的紅血球結構上相當脆弱,容易在脾臟被摧毀,為了避免此一宿命,惡性瘧會在紅血球表面產生黏連蛋白,使血球能黏附在小血管的管壁上而不會隨血液循環通過脾臟[83]。也因為這個機制,瘧疾可能會造成微血管堵塞,產生胎盤瘧疾等相關症狀[84]。感染的紅血球也可能破壞血腦屏障,使腦部微血管出血,造成腦瘧疾[85]。
遺傳抵抗力[編輯]
惡性瘧原蟲帶來的高死亡率和罹病率,造成人類近代史上最大的演化壓力,造成某些對瘧疾有抵抗力的基因篩選出來。不幸地,這些基因通常也會造成紅血球發育不良,導致鐮刀型紅血球疾病、海洋性貧血、蠶豆症、或紅血球表面達菲抗原缺乏[86][87]。
鐮刀型紅血球造成的缺陷和其對瘧疾的免疫力展現了生命在演化上為生存所做的權衡。帶有鐮刀型紅血球基因的的人,血紅蛋白突變成為血紅蛋白S,紅血球因脫水而呈鐮刀狀(正常的紅血球為雙凹圓盤狀),這種紅血球因表面積減少,氧氣輸送的效率較低;且因細胞形狀缺乏彈性,無法順暢地在血液中循環,壽命也較短,所以寄居其內的瘧原蟲往往沒有足夠的時間發育成熟。由於輸氧效率的降低,同型合子(來自父母的兩套染色體都具有鐮刀型紅血球基因)的個體會罹患鐮刀型細胞貧血症,而異形合子的個體則能在沒有嚴重貧血的情形下保有對瘧疾的抵抗力。雖然同型合子個體較短的壽命不利於演化,但由於它對瘧疾的抵抗力,該性狀在瘧疾盛行區仍然保留了下來[87][88]
肝功能受損[編輯]
瘧疾造成肝功能受損的情形並不多見,通常發生於同時罹患病毒性肝炎及慢性肝病的患者。這種症狀有時稱為「瘧疾性肝炎」(malarial hepatitis)[89]。雖然一般認為瘧疾性肝炎很少發生,但近年來有逐漸增加的趨勢,尤其是在印度和東南亞地區。肝功能不佳的瘧疾患者更容易引起併發症,甚至導致死亡[89]。
診斷[編輯]
由於瘧疾沒有特定症狀,非流行區對於有下列事項的患者須保持警覺:
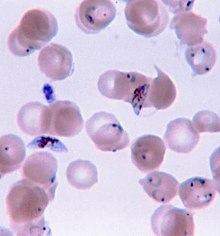
瘧疾的確切診斷必須仰賴血液抹片鏡檢或特定抗原快速篩檢[90][91]。顯微鏡鏡檢是最常用的篩檢方式,光是2010年,全球就篩檢了約1.65億片血液抹片[92]。然而鏡檢有兩大缺點:首先,許多偏鄉並沒有篩檢器材;其次,鏡檢的準確率極度依賴檢驗者的技術以及病人血液中瘧原蟲的數量。血液抹片鏡檢的敏感度大約在75-90%之間,最低可能到50%。市面上的快速篩檢商品的精準度通常較直接鏡檢高,但其敏感度及精密度與製造廠商相關,且變動幅度極大。部分地區的快速篩檢法必須能分辨出惡性瘧,因為其治療策略和其他種瘧疾不同[93];此外,快速篩檢法無法檢測血液中寄生蟲數量[92]。
在擁有瘧疾篩檢實驗室的國家,只要任何進出疫區且身體不適的人,都應該做瘧疾篩檢。但對於無法負擔實驗室檢查的地區,通常僅按照其發燒病史來診斷,因此發燒的患者在無法證明是其他疾病之前都會視同瘧疾治療。這種做法造成了瘧疾的過度診斷,浪費了大量醫療資源,且濫用的結果可能導致病原體產生抗藥性,並可能忽略了非瘧疾性發燒疾病的控制[94]。雖然現在聚合酶鏈式反應的技術已經發展出來,但因為操作複雜,截至2012年前並沒有廣泛用於疫區[5]。
分類[編輯]
- 意識減退
- 明顯虛弱,例如無法行走
- 無法嚥食
- 多處驚厥
- 低血壓(成人小於70 mmHg;兒童小於50 mmHg)
- 呼吸困難
- 循環性休克
- 腎功能衰竭或血紅蛋白尿
- 出血,或血紅素低於50 g/L(5 g/dL)
- 肺水腫
- 血糖低於2.2 mmol/L(40 mg/dL)
- 酸中毒或乳酸濃度高於5 mmol/L。
- 在低流行區血液中寄生蟲數高於100,000隻/µL;高流行區高於250,000隻/µL。
瘧疾會依其性質不同而有不同名字,下表列出瘧疾的異名:[95]
| 疾病名稱 | 病原體 | 備註 |
|---|---|---|
| 寒冷瘧 | 惡性瘧原蟲 | 重症瘧疾影響循環系統,導致發冷及循環性休克。 |
| 黃疸型惡瘧 (夏令黃疸熱) | 惡性瘧原蟲 | 重症瘧疾影響肝臟,導致嘔吐及黃疸 |
| 腦瘧疾 | 惡性瘧原蟲 | 重症瘧疾影響大腦,造成一連串神經性症狀。 |
| 先天性瘧疾 | 多種瘧原蟲 | 瘧原蟲遊母體垂直傳染給胎兒循環系統 |
| 惡性瘧 | 惡性瘧原蟲 | |
| 卵形瘧 | 卵形瘧原蟲 | |
| 三日瘧 | 三日瘧原蟲 | 因發作週期約為三至四日而得名。 |
| 日發瘧 | 惡性瘧原蟲、間日瘧原蟲 | 因發作週期約為一日而得名。 |
| 間日瘧 | 惡性瘧原蟲、卵形瘧原蟲、間日瘧原蟲 | 因其發病周期約為二至三日而得名。 |
| 輸血性瘧疾 | 多種瘧原蟲 | 因輸血、共用針頭,或針扎傷害造成瘧疾的感染。 |
| 間日瘧 | 間日瘧原蟲 |
預防[編輯]
目前為止,瘧疾仍沒有有效的疫苗。疾病防治有賴於藥物治療、消滅瘧蚊、和避免蚊蟲叮咬。瘧疾需在人蚊之間頻繁傳播,因此在人口和病媒的高度密集區才能流行;如果去除當中任一項因素,瘧疾就會逐漸從此區域消失,就如同北美、歐洲、和部分中東地區一樣。然而除非瘧原蟲徹底從世界上消失,瘧疾仍有可能再度爆發。此外,人口密度越高,控制瘧疾的成本越高,這使得某些地區根本無力負擔[96]。
從長期來看,預防比治療更能節省花費,但大多數貧窮國家無力拿出預防的初始成本。各國在瘧疾防治(將瘧疾控制在低盛行率)所需要付出的代價差異很大,舉例來說,中國政府在2010年宣布消滅瘧疾的計畫,雖然經費只佔其公衛支出的一小部分,2015年中國的瘧疾通報人數已降低到只剩3116人[97];然而相似的計畫,卻需投入坦尚尼亞政府約五分之一的公衛預算[98]。
蚊蟲控制[編輯]
病媒控制是藉由降低蚊蟲數量來減緩瘧疾的傳播。個人防治方面可以使用驅蟲藥,最有效的為DEET(DEET)和埃卡瑞丁(picaridin)[99]。在瘧疾流行地區,驅蟲蚊帳(ITNs)和室內殘留噴灑可以有效預防兒童感染[100][101]。及時以青蒿素聯合療法治療確診病例也能遏止病原傳播[102]
蚊帳[編輯]
蚊帳可以有效避免蚊蟲叮咬,阻斷瘧疾的傳播。但蚊帳有時可能會有破洞或空隙,因此有些蚊帳會以殺蟲劑處理,在蚊子找到漏洞前就先將其殺死。驅蟲蚊帳的效果是一般蚊帳的兩倍,且比起沒有掛蚊帳,可以達到70%的保護效果[103]。在2000年到2008年間,驅蟲蚊帳的使用已經挽救了大約250,000名南薩哈拉沙漠的幼童生命[104],南薩哈拉約有13%的家戶擁有驅蟲蚊帳[105]。在2000年,只有約170萬(1.8%)名非洲疫區的兒童受到蚊帳保護;到2007年,這個數字遽增到2030萬人(18.5%),但還是有8960萬名孩童還沒受到蚊帳保護[106]。
2008年,已有約31%的非洲家庭擁有驅蟲蚊帳,大部分的蚊帳以除蟲菊精類處理過,這種殺蟲劑毒性較低,從傍晚至黎明時使用效果最好[68]:215。如果可以的話建議使用床帳,才可以確保蚊帳接觸到地面,以提供完整防護[107]。
室內殘留噴灑[編輯]
室內殘留噴灑即是在家戶的牆壁上噴灑殺蟲劑。蚊子在吸食完血液之後會停在牆壁上休息,此時殘留的殺蟲劑就會將其毒死,阻止它去叮咬下一個人[108]。2006年,WHO列了12種室內殘留噴灑的建議殺蟲劑,包括氟氯氰菊酯、溴氰菊酯等除蟲菊精類,以及著名的DDT[109]。由於之前DDT在農業上遭到大量濫用,斯德哥爾摩公約限制DDT僅能用於公共衛生,且有用量管制[46],但此方法已造成許多蚊子產生抗藥性。另外,此方法殺死了多數居住於室內的蚊子,選汰的結果導致留存的蚊子不傾向待在室內,因此降低了此方法的效果[110]。
其他方法[編輯]
社區參與和衛生教育也能夠提升人們對於瘧疾防治的認知,這一點某些開發中國家做得相當成功[114]。良好的公衛教育能夠促使民眾及早就醫,增加治療後的存活率;同時也能指導民眾以物品覆蓋積水或水缸,阻斷瘧蚊繁殖。這些教育措施已經在一些人口密集區實施[115]。季節性的流行可以採用間歇式預防措施,此方法已成功地控制女人、幼兒、和學齡前學童的瘧疾疫情[116][117]。
藥物預防[編輯]
目前已經有一些預防瘧疾的藥物可以給將前往疫區的人員使用,其中多半也可以用作治療。氯喹對敏感的瘧原蟲仍然有效[118],但由於大部分瘧原蟲對於單一藥物已經產生抗藥性,因此可能需要採用聯合療法,常用的藥物有甲氟喹(mefloquine)、多西環素(Doxycycline)、阿托喹酮(atovaquone)和氯胍鹽酸鹽(malarone)[118]。多西環素和阿托喹酮氯胍鹽酸鹽聯合使用對身體影響最小,而甲氟喹則可能導致死亡、自殺傾向、和神經與精神症狀[118]。這些藥物在服用後無法馬上生效,所以前往疫區的人員一般會在行前一兩周就開始服藥,在離開疫區四周後才停藥。(阿托喹酮氯胍鹽酸鹽除外,該藥只需在行前兩天服用,七天後即可停藥。)[119]
由於藥物價格不菲,在欠已開發國家難以買到,且長期服用有副作用,因此預防藥物在疫區並沒有廣泛採用,通常只有孕婦和短期訪問的遊客才會使用[120],且在疫區使用預防藥物會促使瘧原蟲產生部分抗性[121]。另有研究指出孕婦服用瘧疾預防藥可以增加嬰兒體重並降低貧血風險[122]。
治療[編輯]
非重症瘧疾[編輯]
非重症的瘧疾可以用口服藥物治療,治療惡性瘧最有效的療法是青蒿素聯合療法(即青蒿素配合其他抗瘧藥一起服用,簡稱ACT),它可以減輕瘧原蟲對單一藥物的抗藥性[124],能和青蒿素配合的抗瘧藥包括阿莫地喹(amodiaquine)、本芴醇(lumefantrine)、甲氟喹(mefloquine)或磺胺多辛/乙胺嘧啶 (sulfadoxine/pyrimethamine)[9]:75-86。另一種建議的聯合療法是雙氫青蒿素和喹哌(piperaquine)[9]:21[125]。若用在非重症瘧疾,青蒿素聯合療法在90%的病例中有效[104];若是治療孕婦,世界衛生組織建議在懷孕初期(前三個月)用奎寧和克林黴素,在中後期則用青蒿素聯合療法[126]。在2000年左右,東南亞地區已經出現對青蒿素有抗藥性的瘧疾[127][128]
感染間日瘧、卵形瘧、或三日瘧通常不需住院治療。治療間日瘧必須同時清除血液和肝臟中的病原體,通常使用氯喹或ACT來清除血液中的病原,而肝臟中的則以伯氨喹(primaquine)治療[129],使用他非諾喹(Tafenoquine )則能防止間日瘧復發。[130]
重症瘧疾[編輯]
重症瘧疾通常由惡性瘧造成,其他種瘧原蟲一般只會造成較輕微的症狀。[131]重症瘧疾建議使用靜脈注射抗瘧藥。不論是成人或孩童,青蒿琥酯對重症瘧疾的效果都優於奎寧[132];另一份報告指出青蒿素衍生物(包括蒿甲醚和蒿乙醚)對孩童的腦瘧疾和奎寧一樣有效。[133]。重症瘧疾的治療也包括支持療法,患者於重症加護病房中能得到最好的照顧,這包括控制高燒、監控呼吸困難、低血糖、和低血鉀[62]
抗藥性[編輯]
瘧疾的抗藥性在21世紀是一個日益嚴重的問題[134]。目前已知所有的抗瘧藥都已經出現抗藥性,抗藥性品系的治療相當依賴聯合療法,但青蒿素的價格使得開發中國家根本無力負擔[135],且目前已知最有效的青蒿素聯合療法也在柬埔寨和泰國的邊界地區出現了抗藥性品系,使得此種瘧疾難以治療[136]。使用青蒿素單一藥物的療法30多年來,瘧原蟲長期暴露於此藥物,加上許多患者使用了低於標準的劑量,導致抗藥性品系的出現[137],目前在柬埔寨、緬甸、泰國、越南、寮國都有發現抗青蒿素的品系[138][139]。
預後[編輯]
一般的瘧疾患者在妥善治療之下通常可以完全康復[140];然而有些重症瘧疾的病程進展較為快速,患者可能會在數小時或數天內死亡[141]。最嚴重的病例即使在良好的治療與照顧之下,死亡率仍能高達20%[5]。長期影響方面,有文獻記載感染過重症瘧疾的兒童可能會發育遲緩[142];非重症性的慢性感染也可能導致免疫缺陷,減弱患者對沙門氏菌和EB病毒的抵抗力[143]。
瘧疾造成的貧血會對於孩童快速發育的中樞神經造成不良影響,另外病原體也會直接傷害腦瘧疾患者的腦部[142],有些腦瘧疾患者在痊癒後仍有神經和認知缺陷、行為失調和癲癇等後遺症[144]。臨床試驗表明服用防瘧藥能改善認知能力和學習成績[142]。
流行病學[編輯]
世衛組織估計2010年全球有2.19億個瘧疾病例,導致66萬人死亡[5][146],不過另有估計全球重症瘧疾病例有3.5到5.5億[147],死亡124萬人[148],高於1990年的100萬人[149]。大多數(65%)的病患為15歲以下的兒童[148]。每年大約1.25億孕婦有感染的危險,在撒哈拉以南非洲每年有超過20萬嬰兒因為孕婦感染瘧疾而夭折[56]。西歐每年有約一萬病例,美國有1300-1500個病例[52]。1993年到2003年間,歐洲有約900人死於瘧疾[99]。近幾年,全球的發病數和死亡數都有下降的趨勢。據WHO和UNICEF的報告,瘧疾在2015年的可歸因死亡人數從2000年的98.5萬減少了60%[150] 。這主要得益於廣泛使用噴有殺蟲劑的蚊帳和青蒿素聯合療法[104]。2012年,全球有2.07億人感染瘧疾,估計47.3萬至78.9萬人因此死亡,其中很多是非洲的兒童[2]。非洲自2000年起的抗瘧行動已有初步成效,至2015年發生率已減少了40%[151]。
目前的瘧疾疫區為一條沿赤道分布的廣大帶狀區域,另中南美洲、亞洲和非洲多地都有流行。其中,在撒哈拉以南非洲的死亡率高達85%至90%[152]。據估計,2009年每十萬人口中因瘧疾死亡人數最多的地區為象牙海岸(86.15人)、安哥拉(56.93人)和布吉納法索(50.66人)[153]。2010年的估計顯示死亡率最高的國家是布吉納法索、莫三比克和馬里[148]。瘧疾地圖計劃旨在通過描繪全球瘧疾流行狀況來確定瘧疾流行範圍,評估疾病負擔[154][155],並於2010年發行一張惡性瘧原蟲的流行地圖[156]。截至2010年,共有約100個國家仍為瘧疾疫區[146][157],每年有1.25億國際遊客到過這些國家,超過3萬人被感染[99]。
在大的疫區里,瘧疾的流行分布很複雜,疫區常常緊鄰非疫區[158]。瘧疾流行於熱帶和亞熱帶地區,因為這些地方降水充沛,常年高溫高濕,還有蚊子幼蟲賴以生長繁殖的積水[159]。在較乾旱的地區,通過降雨量可以較為準確地預測瘧疾的爆發[160]。相比城市地區,農村地區瘧疾更為流行。比如大湄公河次區域中的城市幾乎沒有瘧疾流行,但農村地區,包括國境線以及森林邊緣地區就相當流行[161]。相比而言,非洲的城鄉地區都有流行,不過大城市的流行風險較低[162]。
社會與文化[編輯]
經濟影響[編輯]
有證據顯示,瘧疾不僅由貧困產生,而且還反過來導致貧困,阻礙經濟發展[12][13]。雖然瘧疾疫區主要位於熱帶,四季分明的溫帶地區也會受到疫情波及。瘧疾給這些地區的經濟造成不利影響。從19世紀下半葉至20世紀下半葉,瘧疾也阻礙了美國南方的經濟發展[163]。
1995年,無瘧疾的國家平均GDP(按購買力平價)為8268美元,是有瘧疾的國家平均GDP(1568美元)的5倍。從1965年至1990年,無瘧疾的國家人均GDP年均增長2.4%,而有瘧疾的國家增長率只有0.4%[164]。
貧困會增加瘧疾患病率,因為貧窮人口無力負擔防控成本。瘧疾在整個非洲已經造成每年120億美元的經濟損失,其中包括醫療成本、病假、失學、腦瘧疾導致的生產力下降,還有投資和旅遊業的損失[14]。瘧疾已給部分國家帶來沉重負擔,包括30%至50%的住院患者,50%的門診患者和高達40%的公共衛生開支[165]。
偽劣藥品[編輯]
柬埔寨[167]、中國[168]、印尼、寮國、泰國和越南等亞洲國家已經出現高仿真的假抗瘧藥,並造成不必要的死亡[169]。世衛組織說40%的青蒿琥酯類抗瘧藥都是假的,在大湄公河地區情況更糟。世衛組織已經建立了一套快速向有關部門報告假藥的預警系統[170]。假藥只能在實驗室里檢驗出來。製藥公司正努力開發新技術以從源頭和銷售上杜絕假藥[171]。
另一公共衛生問題是劣質藥品泛濫。劣質藥品往往含量不足、受到污染、原料不合格、穩定性差、包裝不合規[172]。2012年的研究顯示,東南亞和撒哈拉以南非洲大約三分之一的抗瘧藥為化學成分或包裝不合格的偽劣藥品[173]。
瘧疾和戰爭[編輯]
歷史上,瘧疾在政治和軍事中扮演著重要角色[174]。1910年諾貝爾醫學獎得主羅納德·羅斯(他自己就是瘧疾生還者)發表了著作《瘧疾的預防》,其中有一章題為「戰爭中瘧疾的預防」。這章的作者,皇家軍醫學院(Royal Army Medical College)衛生學教授梅爾維爾(Colonel C. H. Melville)這樣描述瘧疾在歷次戰爭中的影響:「瘧疾幾乎貫穿了整個戰爭史,至少是公元後的戰爭史……很多十六至十八世紀戰地軍營中出現的發熱疫情,其元兇可能都是瘧疾。」[175]
購買現有抗瘧藥和研發新藥已花掉了巨額經費。在一戰和二戰中,金雞納樹樹皮和奎寧等天然抗瘧藥的供應無法保證,促使大量經費用於其他藥物和疫苗的研發。美國相應的研究機構有海軍醫學研究中心、沃爾特·里德陸軍研究院、美國陸軍傳染病醫學研究院[178]。
另外,1942年美國戰爭地區瘧疾控制辦公室(Malaria Control in War Areas,縮寫MCWA)成立,以控制美國南方地區軍事訓練基地中的瘧疾疫情。該辦公室於1946年變更為傳播疾病中心(Communicable Disease Center),即現在的美國疾病控制與預防中心[179]。
防疫工作[編輯]
全球有數個旨在消除瘧疾的組織。2006年,公益組織「消滅瘧疾」(Malaria No More)定下目標,準備在2015年前消除非洲的瘧疾,目標達成就解散[180]。已有數種旨在保護疫區兒童,減緩疫情擴散的瘧疾疫苗正在進行臨床試驗。截至2015年,全球防治愛滋病、結核病和瘧疾基金(The Global Fund to Fight AIDS, Tuberculosis and Malaria)已經分發5.48億頂噴灑有殺蟲劑的蚊帳以阻止蚊子傳播瘧疾[181]。美國柯林頓基金會努力維持青蒿素市場價格穩定,保障市場需求[182]。其他諸如瘧疾地圖計劃等項目則致力於分析氣候環境資訊,評估病媒蚊的棲息地情況,從而準確預測疫情[154]。隸屬世衛組織的瘧疾政策諮詢委員會(Malaria Policy Advisory Committee,縮寫MPAC)2012年成立,旨在為控制和消除瘧疾提供全方面的戰略諮詢和技術幫助[183]。2013年11月,世衛組織和瘧疾疫苗資助者群組(the Malaria Vaccine Funders Group)定下目標開發阻斷瘧疾傳播的疫苗,爭取最終消滅瘧疾[184]。
一些地區的瘧疾疫情已經消除或大為緩解。美國和歐洲南部的瘧疾一度非常流行,但病媒控制和對患者的監視治療已經消滅了這些地區的瘧疾。這得益於水管理方式的改善(如排乾農田濕地,阻止孑孓繁殖)和衛生措施的進步(如給居室裝上玻璃窗和紗窗)[185]。這樣到了20世紀早期,美國大部分地區已經消滅了瘧疾,個別南方地區在使用殺蟲劑DDT後也在50年代消滅了瘧疾[186]。全球瘧疾根除計劃從1955年開始倡導三管齊下的防治方法:用DDT和室內噴灑控制病媒,經常採集人群的血液塗片以了解流行狀況,以及對受感染的患者提供化學療法。該計劃使蘇利南的首都和沿海城市消滅了瘧疾[187]。1994年到2010年期間,不丹採取了積極的防控策略,使確診病例減少了98.7%。除了在疫區用室內殘留噴灑,發放耐用蚊帳等方式控制病媒外,經濟的發展和衛生服務的普及也減少了不丹的瘧疾發病數[188]。
研究[編輯]
疫苗[編輯]
人體可以自然對於惡性瘧原蟲產生免疫力(或者說免疫耐受),但只有在數年多次感染後才會產生[74]。有研究發現,X光可以使子孢子失去感染力[189],但必須被蚊子叮咬約一千次才能產生足夠抵抗力,無法全面應用[190][191]。
惡性瘧原蟲蛋白質的多態性造成疫苗開發相當困難,至今仍然尚未開發出可上市的瘧疾疫苗[192]。瘧疾疫苗的候選抗原來自於瘧原蟲生活史的各階段,包含瘧原蟲的配子體、受精卵,以及蚊子中腸裡的卵動子。疫苗可以促使個體對這些抗原產生抗體,當蚊子吸取人血時,血液中的抗體可以阻斷瘧原蟲在蚊子體內的生活史[193]。
另一類疫苗則是針對血液其產生的抗原,可惜目前皆成效不彰[194]。例如1990年代,由於瘧疾盛行,SPf66在各地區密集測試,然而效果並不理想[195]。還有一類疫苗是針對前紅血球時期,此類疫苗抗原目前以RTS,S研究最深入[191],並可望於2015年核准[143]。
美國生物技術公司Sanaria正在開發一種針對前紅血球時期的減毒疫苗,稱為PfSPZ。這種疫苗是利用完整的子孢子來誘發免疫反應[196]。2006年,世界衛生組織瘧疾疫苗諮詢委員會發表「瘧疾疫苗技術發展藍圖」,提到2015年其中一項重要目標是「發展第一代核准瘧疾疫苗,其對於重症瘧疾之效力須達50%,且至少維持一年。」[197]
藥物治療[編輯]
瘧原蟲體內具有頂複器,這是一種類似植物質粒體(包括葉綠體)的胞器,由於頂複器帶有自己的基因體,因此有研究認為頂複器來自於瘧原蟲與藻類的二次內共生。頂複器對於瘧原蟲的新陳代謝(如脂肪酸合成)相當重要。頂複器製造了逾400種蛋白質,目前正研究是否可能以這些蛋白質作為標靶,來設計抗瘧藥物[198]。
耐藥性瘧原蟲的出現促使人們研發新的對抗瘧疾的方法,例如讓瘧原蟲吸收吡哆醛—胺基酸加合物,以阻礙其必需的維生素B的生成[199][200]。含有有機金屬配合物的合成抗瘧藥亦頗受研究者們青睞[201][202]。
另一大類試驗中的藥物是螺環吲哚酮藥物,為ATP4瘧原蟲蛋白的抑制劑[203]。這類藥物可將受感染紅血球的鈉平衡破壞,使之老化皺縮。在小鼠身上,這類藥物可以成功引起免疫系統清除受感染細胞。2014年,霍華德·休斯醫學研究所已開始就這類藥物中的(+)-SJ733[203],在人體中進行第一期人體試驗[204]。同類藥物還有NITD246[204]和NITD609[205],同樣也是以ATP4為作用目標。

















沒有留言:
張貼留言